¿Qué es la Melatonina?
El sueño es fundamental para la salud emocional y física de una persona.
El sueño inadecuado es un factor conocido de riesgo para la obesidad, la diabetes, las enfermedades del corazón y la depresión. Las personas que tienen trastornos del sueño e insomnio demuestran una capacidad limitada para cumplir con las tareas diarias relacionadas con la memoria, el aprendizaje, el razonamiento lógico y las operaciones matemáticas (1).
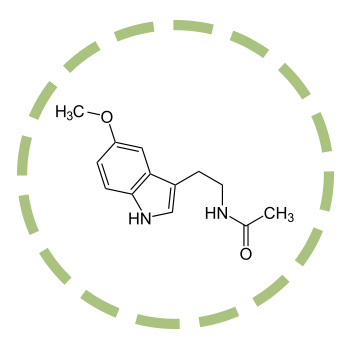
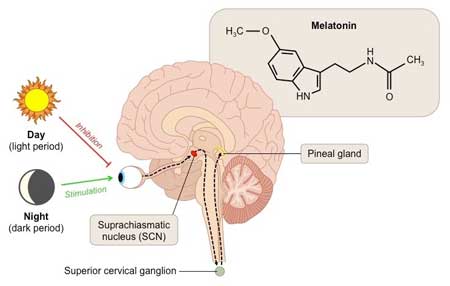
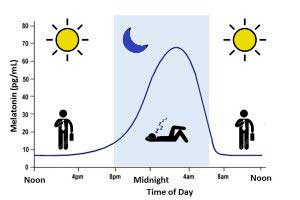
En nuestro cuerpo existe una sustancia que tiene directa relación con la regulación del sueño-vigilia, entre otras funciones fisiológicas, y es la melatonina. La melatonina es una molécula de al menos dos mil millones de años (2), que está presente en todos los animales y plantas con la misma estructura molecular e interviene en un gran número de procesos celulares y vías de regulación.
En los mamíferos la melatonina principalmente se sintetiza y secreta en la glándula pineal (fundamentalmente durante el período nocturno de los ciclos circadianos) (3), aunque también se sintetiza en otros órganos como la retina, el tracto gastrointestinal y el hueso medular (4).